Cos'è il PGT
Il test genetico preimpianto (PGT) è la forma più precoce di diagnosi prenatale, in quanto permette di identificare la presenza di malattie genetiche ereditarie e alterazioni cromosomiche in embrioni ottenuti da fecondazione in vitro prima del loro trasferimento in utero.
A differenza delle altre tecniche di diagnosi prenatale invasiva (villocentesi ed amniocentesi), il PGT evita il ricorso all'interruzione di gravidanza in caso di risultato positivo all'analisi genetica.
Infatti, i recenti progressi nella comprensione del genoma umano e nelle metodiche di diagnostica molecolare hanno portato a una maggiore conoscenza e consapevolezza dei meccanismi alla base di malattie ereditarie, riconducibili ad alterazioni genetiche o cromosomiche. La valutazione del rischio genetico/familiare è particolarmente importante per le coppie che affrontano un percorso di PMA, al fine di intraprendere scelte riproduttive opportune.
Il PGT è l'unico strumento diagnostico che informa le coppie circa lo stato di salute dei propri embrioni prima dell'instaurarsi della gravidanza, in modo da minimizzare i rischi gestazionali, quali l'aborto spontaneo/terapeutico, le sindromi cromosomiche e genetiche fetali.
Il test viene eseguito nell'ambito di un percorso di procreazione medicalmente assistita (PMA) di II livello, che prevede: prelievo degli ovociti e raccolta del liquido seminale, fecondazione in vitro e coltura degli embrioni, i quali vengono analizzati al 5°-6° giorno di sviluppo (stadio di blastocisti) mediante il prelievo di 5-10 cellule dal tessuto embrionale che diventerà la placenta (trofectoderma). Da questo punto di vista la tecnica è sovrapponibile ad una villocentesi, in quanto il materiale di partenza per l'analisi è lo stesso, mentre cambia lo stadio a cui avviene l'analisi, che in questo caso è molto precoce e prima del trasferimento dell'embrione in utero. È possibile analizzare sia il corredo cromosomico nella sua interezza che malattie genetiche associate a singoli geni, le cui mutazioni sono presenti in uno o entrambi i partner della coppia e di cui si vuole evitare la trasmissione.
Il PGT può essere effettuato per diverse indicazioni e in base a queste si distingue in 3 distinte tipologie. In particolare, è possibile effettuare il PGT per malattie monogeniche (PGT-M) in caso di patologie ereditarie autosomiche dominanti, autosomiche recessive, legate al cromosoma X ed in caso di tipizzazione HLA. Il PGT per riarrangiamenti strutturali cromosomici (PGT-SR) è invece indicato nei casi in cui uno o entrambi i partner della coppia presentino un'alterazione strutturale a carico dei cromosomi (inversioni, delezioni e duplicazioni, ma soprattutto traslocazioni). Il PGT per aneuploidie cromosomiche (PGT-A), infine, analizza l'intero corredo cromosomico con l'obiettivo di diagnosticare eventuali alterazioni numeriche a carico di un intero cromosoma o di una sua porzione. Le indicazioni principali del PGT-A includono l'età materna avanzata, la poliabortività ed il ripetuto fallimento di impianto.
Test genetico preimpianto per malattie monogeniche: PGT-M
E' indicato per coppie portatrici di malattie causate da alterazione di un singolo gene, per esempio tra le più frequenti si annoverano fibrosi cistica, talassemia e atrofia muscolare spinale. Tali malattie possono essere dominanti, quindi è sufficiente un genitore affetto per avere un rischio di ricorrenza nella prole (50%), oppure recessive, che rappresentano un rischio per i figli in caso entrambi i genitori siano portatori sani (rischio 25%). Altra categoria di malattie è quella legata al cromosoma X, ovvero patologie che hanno un rischio di ricorrenza diverso tra maschi e femmine. In questo caso, la patologia rischia di essere trasmessa da una madre portatrice, sana o con fenotipo lieve, ai figli maschi che, essendo portatori di un unico cromosoma X, rischiano di manifestare la malattia con sintomatologia grave (rischio 50%).
Per poter valutare la fattibilità del PGT durante la prima visita genetica, è necessario conoscere la base molecolare della malattia familiare. Prima di effettuare l'analisi sugli embrioni, viene effettuato un set-up preclinico per verificare la fattibilità dell'indagine e l'informatività dei polimorfismi utilizzati per l'indagine: vengono raccolti i campioni di DNA e l'anamnesi della coppia e dei parenti disponibili; successivamente vengono analizzati sia l'alterazione genetica causativa della malattia, sia diversi marcatori molecolari fiancheggianti, ovvero dei polimorfismi di lunghezza (STR) o di sequenza (SNP). Si ottiene così l'identificazione dell'aplotipo a rischio, ovvero la porzione di cromosoma che contiene il gene malato, la cui trasmissione viene analizzata nei vari membri della famiglia coinvolti nell'indagine preliminare. La presenza dei marcatori è fondamentale per dare solidità all'analisi (spesso la sola mutazione non è sufficiente) e per eseguire un'analisi indiretta in caso la mutazione causativa della patologia non fosse direttamente visibile con analisi diretta. Successivamente al set-up preclinico, in caso di fattibilità positiva all'analisi, la coppia può iniziare il percorso di PMA, al fine di ottenere un numero sufficiente di embrioni da analizzare per la specifica malattia genetica. Viene quindi eseguito il PGT-M sul DNA ottenuto da biopsia della blastocisti, i cui risultati vengono poi discussi con la coppia per programmare il trasferimento dell'embrione non affetto in utero.
Le principali tecniche di analisi utilizzate in PGT sono il sequenziamento Next Generation Sequencing (NGS) e la tecnologia SNP-array. Entrambi i metodi danno informazioni accurate (>99%) di tipo qualitativo e quantitativo, che permettono di dedurre il genotipo di ogni embrione analizzato.
Test genetico preimpianto per riarrangiamenti strutturali: PGT-SR
Consiste nell'analisi delle anomalie della struttura dei cromosomi ed è indicato per coppie in cui uno dei due partner (o entrambi) sia portatore di un'anomalia cromosomica strutturale. Le anomalie strutturali più frequenti sono le inversioni, delezioni e duplicazioni, ma soprattutto le traslocazioni. Individui portatori di riarrangiamenti strutturali bilanciati spesso sono sani ma rischiano di avere una prole affetta. Infatti, durante la meiosi maschile o femminile di individui portatori, può accadere che si generino gameti con sbilanciamenti, che unendosi a gameti con corredo cromosomico normale danno origine ad embrioni affetti. Tale condizione di portatore sano spesso viene alla luce dopo ripetuti fallimenti d'impianto o aborti spontanei.
Anche in questo caso la fattibilità del test viene valutata durante la prima visita genetica in presenza di un referto di laboratorio che attesta la presenza dell'anomalia in uno o entrambi i partner. Successivamente, la coppia può iniziare il percorso di PMA con l'analisi degli embrioni ottenuti (il test non chiede alcun set-up preclinico).
L'analisi PGT-SR verifica la normalità di tutti i 46 cromosomi negli embrioni analizzati e utilizza principalmente la tecnologia NGS.
Test genetico preimpianto per aneuploidie cromosomiche: PGT-A
Il PGT-A permette di analizzare l'intero corredo cromosomico rilevando la presenza di aneuploidie a carico di un cromosoma intero o parziali alterazioni cromosomiche. È finalizzato all'individuazione degli embrioni euploidi, ovvero quelli con le migliori probabilità di impiantarsi in utero ed arrivare a termine di gravidanza.
E' indicato per coppie che si trovino in una delle seguenti condizioni: età materna avanzata (>35 anni), ripetuti fallimenti di impianto durante un percorso di PMA, ripetuti aborti spontanei idiopatici o cromosomici, ripetute interruzioni di gravidanza per feto con anomalia cromosomica.
In questo caso il rischio di ottenere embrioni affetti, che non è prevedibile come accade per le malattie monogeniche o per le anomalie strutturali, dipende da diversi fattori genetici e non genetici, in particolare dall'età del partner femminile.
I principali vantaggi di questa analisi sono: riduzione del tempo necessario per ottenere una gravidanza a termine, riduzione degli aborti spontanei, riduzione delle interruzioni di gravidanza per feto affetto da aneuploidie cromosomiche. Il PGT-A dovrebbe essere eseguito anche su embrioni precedentemente analizzati per PGT-M e scelti per l'impianto, per aumentare la probabilità di ottenere una gravidanza a termine.
La tecnica di elezione che permette di analizzare le anomalie di numero è l'NGS a bassa copertura, che ha permesso di ridurre sensibilmente i costi dell'analisi ma ha al contempo messo in evidenza il fenomeno del mosaicismo embrionario.
Per mosaicismo si intende la presenza di linee cellulari o singole cellule con corredo cromosomico differente.
Tale fenomeno è molto comune nei primi stadi di sviluppo embrionario, ed ha un'incidenza allo stadio di blastocisti di circa il 3-5%. Una recente pubblicazione della Società Europea di Riproduzione Umana (ESHRE 2022) ha tracciato delle linee di indirizzo in merito al fenomeno del mosaicismo embrionario, che sinteticamente riportano:
- I laboratori che decidono di classificare gli embrioni come suggestivi di mosaicismo devono informare a priori la coppia dei parametri utilizzati per definire un embrione a mosaico e quale soglia hanno stabilito per definire un mosaico di alto e basso grado. La soglia suggerita dalle Raccomandazioni Europee per definire il grado di mosaicismo dell'embrione è 50%.
- Non è possibile considerare aneuploide un embrione a mosaico.
- La rilevazione di un mosaicismo cromosomico nelle poche cellule della biopsia potrebbe non riflettere la costituzione dell'intero embrione né può predire la sua vitalità.
- Non è raccomandato eseguire un nuovo ciclo di PMA se la coppia ha ancora disponibili da trasferire embrioni con basso grado di mosaicismo.
- Non è raccomandato scartare dal trasferimento embrioni con basso grado di mosaicismo.
- Non è raccomandato eseguire una re-biopsia degli embrioni con basso grado di mosaicismo per confermare il loro status cromosomico.
- A tutte le donne che decidono di trasferire un embrione in mosaico a basso grado deve essere offerta una consulenza genetica per discutere del follow-up prenatale della gravidanza. Un riscontro di mosaicismo a basso grado all'analisi della biopsia embrionale non rappresenta comunque una indicazione diretta ad eseguire diagnosi prenatale invasiva.
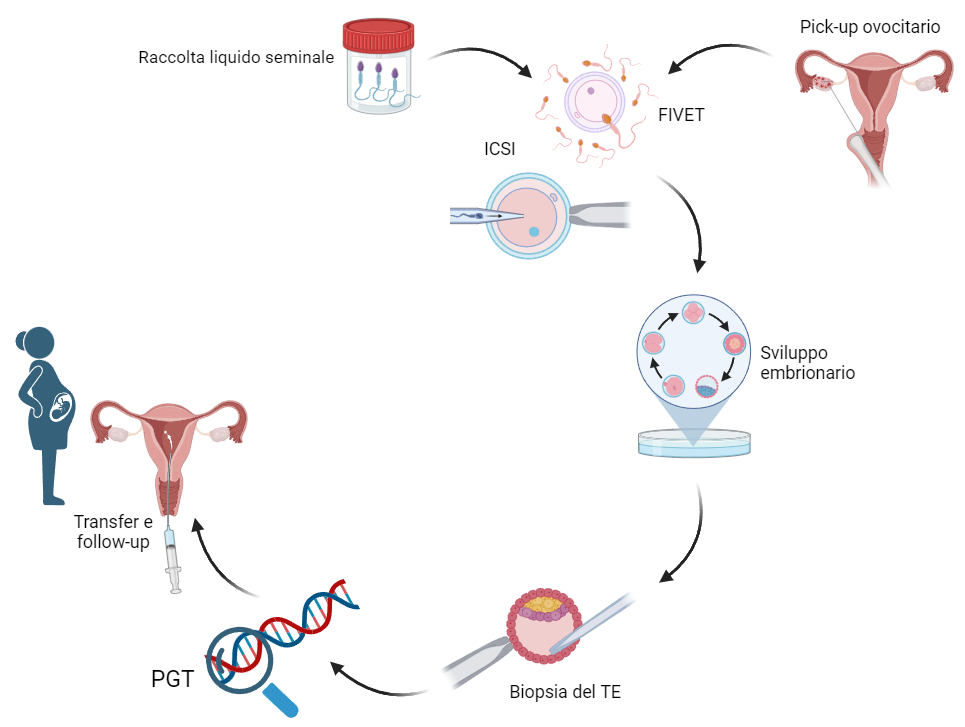
Le tecniche di PMA
Per eseguire il PGT è necessario che la coppia esegua una tecnica di PMA di II livello, ovvero FIVET o ICSI (omologa o eterologa).
FIVET (fecondazione in vitro e trasferimento embrionale) ed ICSI (iniezione intracitoplasmatica dello spermatozoo) rientrano tra le tecniche di PMA di II livello, poiché prevedono una manipolazione dei gameti femminili (ovociti) e maschili (spermatozoi) ed una successiva fecondazione extra-corporea.
In entrambe le tecniche la fecondazione avviene in vitro, ossia al di fuori della sede anatomica preposta (tratto terminale delle tube), nelle seguenti tappe
- Stimolazione ovarica controllata
Mediante la somministrazione giornaliera di gonadotropine esogene per via sottocutanea si induce una "superovulazione" allo scopo di ottenere, nel corso dello stesso ciclo, una crescita follicolare multipla. Per prevenire il picco prematuro di LH si utilizzano gli agonisti o antagonisti del GnRH.
- Monitoraggio dell'ovulazione
E' indispensabile un monitoraggio costante dello sviluppo follicolare, da eseguire tramite ecografie e dosaggi dell'estradiolo, qualsiasi sia il protocollo di stimolazione adottato. Di solito il monitoraggio inizia dopo 5-6 giorni dal ciclo e prosegue con valutazioni effettuate a giorni alterni o quotidianamente, a seconda delle necessità. Le ecografie consentono di misurare il numero e il diametro dei follicoli, mentre i dosaggi di estradiolo e progesterone sono indice dello stadio di maturazione.
- Induzione della maturazione ovocitaria
Quando il diametro dei follicoli raggiunge le dimensioni di circa 16 - 20 mm, si induce la maturazione finale degli ovociti tramite la somministrazione di hCG (gonadotropina corionica) o di un agonista del GnRH.
- Prelievo ovocitario (pick-up)
Circa 34 - 36 ore dopo l'induzione dell'ovulazione si esegue l'aspirazione eco-guidata del liquido follicolare. Tale procedura chirurgica si effettua in sala operatoria in analgosedazione.
- Preparazione del liquido seminale
Il liquido seminale viene trattato in laboratorio al fine di ottimizzare la quantità di spermatozoi dotati di motilità e di morfologia regolare da utilizzare per la fecondazione.
- Fecondazione in vitro
Se non sussiste un fattore maschile severo, ciascun ovocita è incubato con una quantità opportuna di spermatozoi capacitati con terreno di coltura, per circa 16-20 ore (FIVET).
In presenza di un fattore maschile severo si ricorre alla ICSI attraverso l'iniezione, tramite micromanipolatore, di un singolo spermatozoo nel citoplasma dell'ovocita. Anche in caso di successiva esecuzione di PGT, si preferisce utilizzare la tecnica ICSI (iniezione intracitoplasmatica dello spermatozoo) per evitare la contaminazione da materiale cellulare non embrionario.
- Coltura embrionaria in vitro, biopsia e congelamento
Successivamente alla fecondazione in vitro viene allestita la coltura embrionale in idonei terreni, al fine di favorire lo sviluppo dello zigote fino allo stadio di blastocisti, che può avvenire tra il quinto e il settimo giorno di coltura. Una volta raggiunto lo stadio di blastocisti, viene eseguita la biopsia embrionale delle cellule del trofectoderma e la crioconservazione dell'embrione. Il materiale bioptico viene dunque inviato al laboratorio di genetica per il test genetico preimpianto.
- Transfer embrionario
Dopo l'identificazione tramite PGT degli embrioni non affetti, si procede nel ciclo mestruale successivo al trasferimento in utero di un embrione allo stadio di blastocisti. L'embrione viene trasferito mediante un sottile catetere che viene inserito nel canale cervicale fino ad arrivare al fondo dell'utero.
Le tecniche di biopsia embrionaria
La biopsia dell’embrione può essere effettuata prelevando:
- i globuli polari
- un blastomero
- il trofectoderma
I globuli polari (GP) sono sottoprodotti delle divisioni meiotiche dell'ovocita. Non hanno funzione riproduttiva e possono essere facilmente rimossi senza compromettere lo sviluppo dell'embrione. La biopsia può essere applicata con un metodo a fase singola o a due fasi: la fase singola avviene in stato di zigote e consiste nella rimozione simultanea del primo GP e del secondo GP a 16-18 h dall'inseminazione. Il metodo a due fasi prevede due diverse biopsie. La prima estrazione di GP avviene in stadio MII dell'ovocita, mentre la seconda estrazione del GP dopo 16-18 h dall'inseminazione. Durante la biopsia del GP si incide la zona pellucida (ZP) dell'ovocita meccanicamente con un ago sottile oppure con laser. Il principale limite della biopsia del GP è che fornisce solo informazioni genetiche materne e non paterne. Inoltre, il tasso di gravidanza ottenuta da questa tecnica è estremamente basso (5-10%) per cui la tecnica è stata progressivamente abbandonata in favore della biopsia delle cellule del trofectoderma.
Il prelievo del singolo blastomero viene invece eseguito quando l'embrione raggiunge il 3° giorno di coltura in vitro, allo stadio di otto cellule, mediante l'utilizzo del laser. Purtroppo studi recenti (Scott et al., 2013) hanno evidenziato che la rimozione di un blastomero in 3° giornata compromette lo sviluppo dell'embrione e la sua vitalità, causando tassi di impianto ridotti di circa il 30% rispetto a embrioni non bioptizzati.
Per questo motivo, la biopsia del blastomero è attualmente una tecnica poco utilizzata ed è stata quasi completamente sostituita dalla biopsia allo stadio di blastocisti.
La biopsia della blastocisti viene eseguita al 5°/6° giorno di coltura. La blastocisti è composta da due diversi tipi cellulari: la massa cellulare interna, che evolverà nei tessuti fetali, ed il trofectoderma (TE), precursore della placenta. I vantaggi correlati alla biopsia del TE sono principalmente tre: 1) il TE non è coinvolto nella formazione del feto in quanto formerà tessuti extra-embrionali; 2) gli embrioni allo stadio di blastocisti hanno già attivato il loro genoma, e questo consente un'analisi più accurata; 3) per eseguire il PGT è sufficiente una campione di circa 5-8 cellule, ovvero una quantità minima considerando che la blastocisti è formata da circa 200-250 cellule.
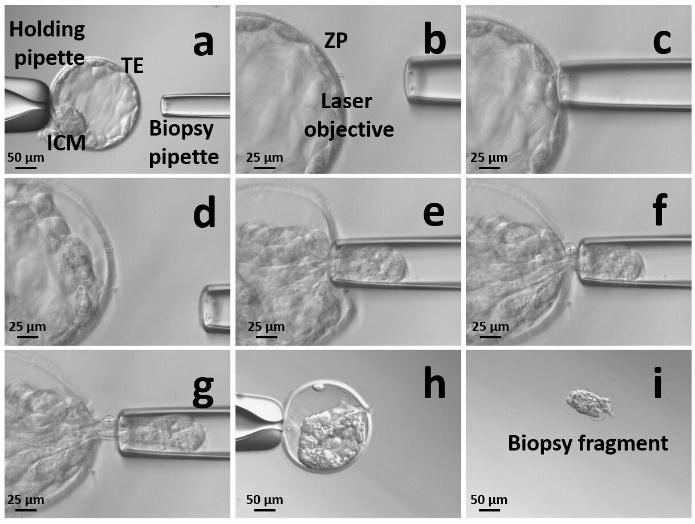
Biopsia su blastocisti mediante laser. Maggiulli et al., Developmental Biology, 2019
In base alle attuali evidenze scientifiche, l'uso della biopsia allo stadio di blastocisti per qualsiasi procedura ed indicazione di PGT è raccomandato e considerato "gold standard" a livello internazionale.
La classificazione degli embrioni
Esistono almeno due classificazioni degli embrioni prodotti attualmente utilizzate in Italia: la classificazione di Gardner & Schoolcraft (1999) e quella di Capalbo (2014).
Il sistema di classificazione internazionale delle blastocisti proposto da Gardner e Schoolcraft adotta numeri e lettere per indicarne l'espansione e la morfologia.
I numeri (da 1 a 6) indicano il grado di espansione della blastocisti da minore a maggiore.
Le lettere stabiliscono il criterio morfologico per valutare la MCI (Massa Cellulare Interna) e il TE (Trofectoderma) in tre categorie, di qualità decrescente, in base al numero di cellule, la loro coesione e l'aspetto (A, B e C ).
Secondo questa classificazione la blastocisti migliore per i parametri valutati è quella classificata come 6-A-A.
Le due tabelle sottoriportate specificano le codifiche dei parametri di valutazione.
Valutazione del grado di espansione:
| Grado di espansione |
Immagine |
Descrizione |
| Grado 1 - Blastocisti precoce |

|
Cavità del blastocele inferiore alla metà del volume dell'embrione |
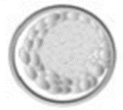
| Grado 2 - Blastocisti |
|
Cavità del blastocele uguale o maggiore alla metà del volume dell'embrione
|
| Grade 3 – Blastocisti completa |

|
La cavità del blastocele riempie completamente l'embrione |
| Grado 4 – Blastocisti espansa |

|
La zona pellucida è visivamente assottigliata a causa dell’aumento del volume della blastocisti |
| Grado 5 - Blastocisti in Hatching |

|
Il trofectoderma comincia ad erniare attraverso la zona pellucida |
| Grado 6 – Blastocisti completamente in hatching |

|
La Blastocisti è completamente fuoriuscita dalla zona |
Valutazione del grado della MCI e del TE:
| Grado MCI |
Immagine |
Descrizione |
| A |

|
MCI di grandi dimensioni, molte cellule addensate tra loro |
| B |

|
Dimensioni più piccole con cellule meno compattate |
| C |

|
Pochissime cellule visibili, indistinguibili con il TE |
| Grado TE |
Immagine |
Descrizione |
| A |

|
Piccole cellule identiche formano un epitelio continuo altamente unificato |
| B |

|
Meno cellule con strato irregolare e discontinuo |
| C |

|
Cellule di dimensioni irregolari che formano un epitelio con più lacune |
Il sistema di classificazione delle blastocisti proposto da Capalbo (2014) rivede i parametri della classificazione internazionale adottando una codifica a lettere (A,B,C e D) da maggiore a minore per classificare il grado di espansione e una codifica numerica (1,2 e 3) per indicare la morfologia di MCI e TE.
Secondo questa classificazione la blastocisti migliore per i parametri valutati è quella classificata come A-1-1.
Le due tabelle sottoriportate specificano le codifiche dei parametri di valutazione.
| Grado di espansione |
MCI |
TE |
| A |
Blastocisti completamente in hatching |
1 |
MCI ben visibile, cellule addensate tra loro |
1 |
Epitelio ben organizzato con diverse cellule |
| B |
Blastocisti in hatching |
2 |
MCI più piccolo con cellule poco compattate |
2 |
Poche cellule con TE irregolare |
| C |
Blastocisti completamente espansa |
3 |
MCI difficile da distinguere con pochissime cellule di bassa qualità |
3 |
Poche cellule con bassa qualità |
| D |
Blastocisti non espansa |
|
|
|
|
La consulenza genetica
La consulenza genetica rappresenta uno step di assoluta importanza e viene effettuata da genetisti con comprovata esperienza nella diagnosi preimpianto. Durante la consulenza genetica pre PGT-M e PGT-SR la coppia viene informata sulla condizione genetica in esame e sulle percentuali di rischio di ricorrenza; viene discussa la gravità, la penetranza, la variabilità fenotipica, la prognosi, le opzioni terapeutiche esistenti. Inoltre, viene verificata la fattibilità di diagnosticare il difetto genetico in questione mediante il PGT, discutendo le eventuali opzioni riproduttive alternative (diagnosi prenatale invasiva e non invasiva, fecondazione eterologa).
Alla coppia viene illustrato il percorso di diagnosi preimpianto, la necessità per il PGT-M di effettuare uno studio preliminare sul DNA della coppia, propedeutico all'analisi indiretta sull'embrione, e la necessità di coinvolgere ulteriori familiari di primo grado.
Con la coppia vengono esaminate le metodologie e le strategie diagnostiche disponibili per la diagnosi genetica, illustrando i livelli di accuratezza, i parametri qualitativi, le tempistiche, i vantaggi e i limiti della metodica, nonché la percentuale di errata diagnosi; per tale motivo, in caso di gravidanza, viene discussa con la coppia della possibilità di effettuare la diagnosi prenatale per confermare il risultato del PGT e l'eventuale follow-up della gravidanza e dei bambini nati.
Durante la consulenza il genetista informa la coppia circa l'attendibilità e l'accuratezza diagnostica in relazione al campione bioptico ottenuto, illustra tutte le potenziali limitazioni come la possibilità che la diagnosi non sia conclusiva o fattibile per alcuni embrioni, la probabilità di ottenere un embrione non affetto e la possibilità che tutti gli embrioni risultino affetti, dunque non trasferibili per la presenza di difetti genetici e/o cromosomici.
Il processo decisionale riguardante quali embrioni sono trasferibili deve essere discusso con la coppia prima dell'inizio del ciclo di PMA-PGT ed aggiornato al bisogno durante o dopo la conclusione del ciclo.
In fase di consulenza è opportuno discutere con la coppia la probabilità di ottenere una gravidanza / nascita e il rischio di aborto per ciclo iniziato e per transfer effettuato, correlati all'età materna e alla specifica malattia genetica; altresì importante è informare sul destino degli embrioni affetti, dei non affetti in sovrannumero rispetto alle esigenze di pianificazione familiare della coppia, il destino degli embrioni non diagnosticati o di quelli non idonei al trasferimento. In caso di dubbio diagnostico e/o necessità di conferma dei risultati ottenuti, viene discussa la possibilità di effettuare una seconda biopsia del trofectoderma, previo consenso informato.
Infine, una consulenza addizionale deve essere fornita alla fine dell'analisi di set-up preclinico, in cui viene illustrata l'effettiva fattibilità tecnica del test e il rischio a posteriori di trasmissione della malattia, e una consulenza post PGT multidisciplinare, in cui viene spiegato e chiarito il referto di laboratorio e l'esito del test sugli embrioni.
Data ultimo aggiornamento: 01 agosto 2024